Классификация облегчает изучение веществ, поэтому вещества похожего состава объединяют в классы. Вещества, относящиеся к какому-либо одному классу, обязательно обладают какими-то общими, похожими химическими свойствами. Например, оксиды это вещества, состоящие из атомов двух элементов, один из которых - кислород.
SO2 | SO3 | CO2 | CaO | Fe2O3 |
оксид серы (IV) | оксид серы (VI) | оксид углерода (IV) | оксидкальция | оксиджелеза (III) |
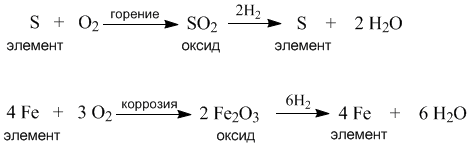
 Формулы оксидов похожи друг на друга тем, что каждая включает только два элемента, один из которых – обязательно кислород. Есть у них и общие химические свойства. Например, все оксиды могут быть получены при взаимодействии элементов с кислородом. И наоборот, из любого оксида можно получить элемент в чистом виде с помощью реакции этого оксида с водородом или другим восстановителем.
Формулы оксидов похожи друг на друга тем, что каждая включает только два элемента, один из которых – обязательно кислород. Есть у них и общие химические свойства. Например, все оксиды могут быть получены при взаимодействии элементов с кислородом. И наоборот, из любого оксида можно получить элемент в чистом виде с помощью реакции этого оксида с водородом или другим восстановителем.
Помимо общих свойств, у соединений одного класса могут наблюдаться и различия в химическом поведении. Например, есть оксиды кислотные и оксиды основные.
Кислотные оксиды способны превращаться в кислоты.
SO3 | + | H2O | = | H2SO4 |
кислотный оксид | вода | серная кислота |
Кислотные оксиды образуются (за редким исключением) из неметаллов.
Основные оксиды способны превращаться в основания. Они образованы металлами.
CaO | + | H2O | = | Ca(OH)2 |
основнойоксид | вода | гидроксид кальция - основание |
Образующиеся из оксидов кислоты и основания являются самостоятельными классами соединений. Давайте выясним, что объединяет между собой кислоты и что – основания.
Важнейшее общее свойство кислот заключается в том, что они способны предоставлять свои ионы водорода для реакций с другими веществами:
H2SO4 | + | Zn | = | ZnSO4 | + | H2(газ) |
серная кислота | цинк | два атома водорода замещены цинком |
HCl | + | AgNO3 | = | AgCl (осадок) | + | HNO3 |
солянаякислота | соль серебра | атом водорода замещен серебром |
Таким образом, молекула любой кислоты состоит из атомов водорода и оставшейся части молекулы, которая называется кислотным остатком:
H2SO4 – серная кислота (SO4 2– кислотный остаток),
HCl – соляная кислота (Cl - кислотный остаток),
HNO3 – азотная кислота (NO3- – кислотный остаток).
Рядом с кислотным остатком указан его электрический заряд. Кислотный остаток может выступать в химических реакциях как самостоятельная частица.
Кислотные остатки могут переходить без изменений из одного соединения в другое.
Важнейшим общим свойством оснований является следующие: для реакций с другими соединениями они могут предоставлять свои гидроксогруппы (группы ОН- ). Эти группы ведут себя в реакциях оснований как отдельные частицы и могут без изменений переходить в новое соединение.
Ca(OH)2 + 2 HCl = CaCl2 + 2 H2O (или 2 НОН)
(в этой реакции обе гидроксогруппы перешли из Ca(OH)2 в молекулы воды)
Гидроксогруппы могут переходить без изменений из одного соединения в другое.
Чтобы подчеркнуть роль гидроксогрупп в свойствах оснований, их формулы пишут не так, как формулы кислот. Например: Ca(OH)2(но не H2CaO2).
Материал с сайта http://www.hemi.nsu.ru/ ВЕРНУТЬСЯ НАЗАД